原标题:一次性运用血液透析管路计划规划
临床实验依据产品申报用处、实验意图考虑归入病种和严峻程度,在实验计划中应具体阐明当选/扫除规范以及间断实验规范。
1.临床实验基本要求
实验计划应清晰研讨意图、研讨人群、调查目标、对照挑选及研讨规划类型等。多中心临床实验由多位研讨者依照同一实验计划在不同的临床实验组织中同期进行。
实验品和对照品挑选准则:
申报产品挑选实验品时,主张挑选原材料和组件最全,通过全项目注册检测的类型进行临床实验。
如进行随机对照实验,应具体描绘对照品的规格类型、出产厂商和批号、对照品挑选依据等。对照品应挑选现已取得有用医疗器械注册证、有切当作用和安全性的产品。对照品的原材料、功用结构、适用范围和运用办法等应尽量与实验品共同。实验组和对照组的实验条件、办法过程、临床调查项目、点评依据等应相同。
2.受试者当选和扫除规范
(1)当选规范
①承受血液透析医治3个月以上的保持性血液透析,或许血液透析和血液透析滤过医治患者(适用于含置换液管产品)、或许血液透析和血液透析联合血液灌流患者(适用于含灌流器连接收产品),医治办法为每周2—3次,每次不小于4小时。
②年纪18—75岁,性别不限。
③血液透析或血液透析滤过期血液流速不小于200ml/min。
④自愿参加并签署书面知情赞同书。
(2)扫除规范
①一起运用其他血液净化疗法,并对本实验点评有影响的患者;
②妊娠及哺乳期妇女,以及近期预备怀孕者;
③患有严峻贫血、感染、肿瘤、活动出血,以及严峻的心、肝、肺脏疾病者;
④颅内出血或颅内压增高患者,以及难以操控的高血压/低血压患者;
⑤有精力性疾病或病史者、吸毒者、艾滋病、梅毒、乙肝、丙肝病毒阳性患者;
⑥体重小于35kg患者;
⑦1个月内参加过其他临床实验者;
⑧既往对体外循环管路、血液净化器械有过敏史者;
⑨研讨者以为不适合入组者。
3.临床调查目标
(1)首要有用性点评目标:
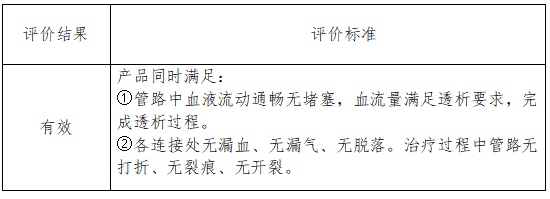
血液透析成功率(为成功完结血液透析的患者数占悉数透析患者的份额)。成功完结血液透析界说为:产品点评成果到达有用要求。具体点评规范见下表。
(2)非有必要有用性点评目标:
①管路外观(柔软度、透明度和光洁度,是否简单调查气泡);
②泵管弹性,碾压后恢复程度,有无显着变形;
③其他组件功用是否满意运用上的要求。
如产品声称具有特别功用,或许包含特别组件,主张将该功用或组件列入有用性点评中。
(3)安全性点评目标:
①透析前、透析开端后15分钟和透析完结后血常规(WBC、RBC、Hb、PLT)改变;
②透析前、后血液C反响蛋白浓度的改变;
③透析前、后外周血白蛋白、球蛋白、ALT、AST的改变;
④透析前、透析开端后15分钟血气(PO2、PCO2)的改变;
⑤透析前、透析开端后15分钟和透析后体温、心率、呼吸和血压等生命体征改变;
⑥透析过程中、透析后不良反响(如心悸、畏寒、发热、皮疹、皮肤潮红、皮肤瘙痒等)的发作状况。
透析采血点为透析前、透析开端后15分钟和透析结束时,依照《血液净化规范操作规程(2010版)》对血液透析充沛性点评血标本留取的抽取办法收集血样。透析前及透析开端后15分钟测血气时,于血透管路动脉端采样口处收集血标本。一切临床实验组织的采血办法应相同。
记载临床实验中不良事情,并剖析其原因、成果,以及与实验产品的联系。
4.样本量
样本量依据受试产品的临床实验规划类型、首要点评目标等因从来确认。需具体写明样本量预算选用的软件或公式,以及公式中的一切参数及其估量值,还应结合临床实在的状况考虑实验目标的或许掉落率等要素。关于非劣效实验规划,应由临床专家和核算学家事前给出具有临床意义的非劣效界值。关于单组目标值规划,亦需清晰给出目标值确认的合理依据。
以下举例内容仅供参考:
假如某产品选用非劣效实验规划,估量首要有用性点评目标“血液透析成功率”为98%,假定被试产品作用与对照产品作用适当,当非劣效界值取5%,等份额入组分配,核算学查验水准取α=0.025(单侧),β=0.20(掌握度取80%)。核算每组所需样本量为124例,两组合计248例。假如考虑到实验过程中约5%的病例掉落(含因严峻违反计划而除掉的状况),实验归入病例数应不低于260例。
假如选用单组目标值规划,假定受试产品首要有用性点评目标“血液透析成功率”为98%,目标值为95%,核算学查验水准取α=0.025(单侧),β=0.20(掌握度取80%)。核算所需样本量为331例。在此基础上考虑必定份额的掉落率,终究的入组规划确认为335例。
为了可以更好的确保受试者的安全性和数据的完整性,主张有条件的选用依据互联网的中心随机体系或中心注册挂号体系(单组目标值规划),以备监管部门盯梢稽察悉数参加实验病例。
5.临床实验核算剖析办法
数据剖析时应考虑数据完整性,一切签署知情赞同并运用了受试产品的实验目标有必要归入终究的核算剖析。剖析受试者退出或掉落的严峻程度和发作原因。数据除掉或偏倚数据的处理有必要有科学依据和具体阐明,并应进行灵敏度剖析,以点评其对研讨成果的影响。
数据剖析应选用国内外公认的核算剖析办法。实验计划应清晰核算查验的类型、查验假定、断定作用有临床意义的界值(非劣效界值)等,界值的确认应有依据。
揣度实验产品有用性是否满意临床使用需求时,不能仅将p值作为对首要研讨结尾进行点评的依据。关于随机对照实验规划,应核算组间达标率差的双侧95%置信区间;关于单组目标值实验规划,应给出达标率及其单侧97.5%置信区间的估量,并清晰置信区间的核算办法。
应对一切实验过程中发作的不良事情进行点评,并描绘其品种、发作频率以及与被验证器械的联系。
6.核算剖析成果
核算剖析应依据一切临床实验数据剖析得出,并用于编撰临床实验陈述。核算剖析成果应至少包含但不限于临床实验完结状况、人群基线描绘、作用/作用点评及安全性点评等。对一切实验目标进行安全性点评剖析,不能遗失任何不良事情(包含实验前正常、实验后反常并有临床意义的实验室目标等)。掉落病例应列表逐例陈说掉落原因。单组目标值规划的实验,主张以意向性医治准则进行首要剖析,关于掉落病例首要作用目标应按无效处理。
7.临床陈述
提交各分中心临床实验小结。主张依据核算剖析成果编撰并出具临床实验陈述。其间应供给患者一般材料(性别、年纪、体重等)。临床陈述内容包含:实验目标材料、实验办法、实验和首要目标检测设备、点评办法和规范、实验成果和定论、副反响、不良事情、并发症及其处理、适用范围、禁忌症和需求留意的几点、存在问题及改善定见等。
临床实验陈述应与研讨计划保持共同。陈述一切不良事情发作时间、原因、具体表现、成果及与实验用器械的联系,关于所采纳的处理办法需予以清晰。无论是预期还对错预期不良事情,都应照实记载和陈述。对因不良事情而间断研讨以及呈现重度或严峻不良事情的病例,加以特别的注明。临床陈述中的核算剖析成果应经核算学专家审阅。
责任编辑:











